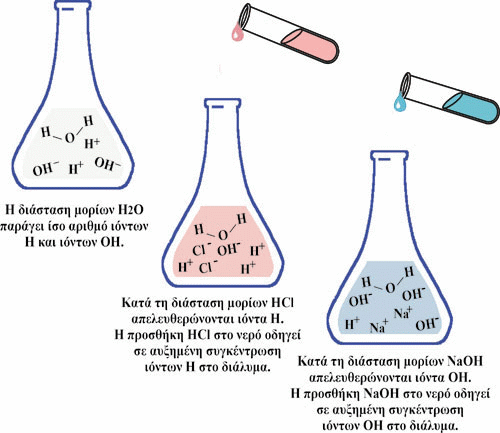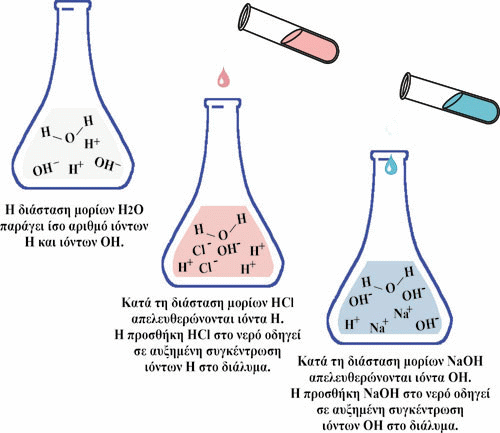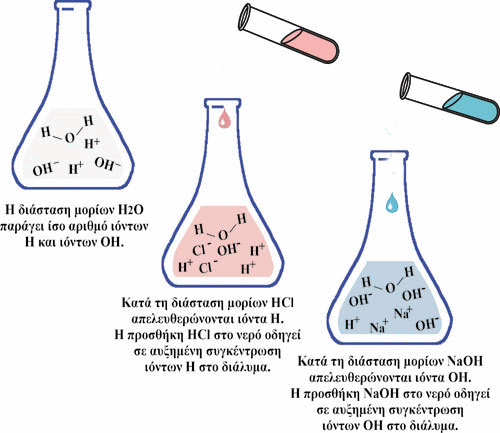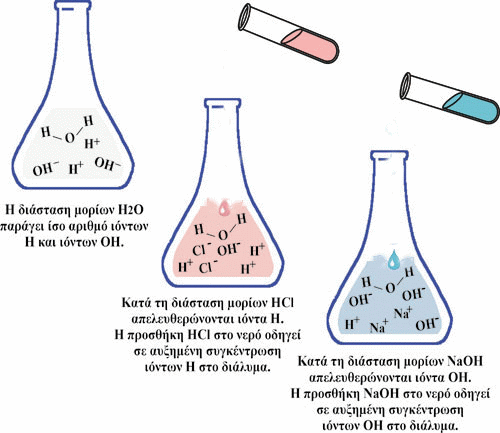
Εικόνα 16. Η προσθήκη οξέος σε ένα υδατικό διάλυμα μειώνει το pH του, ενώ η προσθήκη βάσης αυξάνει το pH του διαλύματος.
Αβιοτικό στοιχείο
Ενεργός οξύτητα (pH)
Η ενεργός οξύτητα ενός διαλύματος εξαρτάται από τη συγκέντρωση των ιόντων υδρογόνου και υποδηλώνει πόσο όξινο ή αλκαλικό είναι το διάλυμα σε μια συγκεκριμένη θερμοκρασία (εικ.16). Η τιμή του pH των φυσικών νερών κυμαίνεται συνήθως μεταξύ 6,5 και 8,5, εύρος τιμών που επιτρέπει την επιβίωση των υδρόβιων οργανισμών. Ακραίες τιμές pH συναντώνται σε ηφαιστειακές λίμνες (pH?2) και σε μερικές κλειστές αλκαλικές νατριούχες λίμνες (pH?12).

Εικόνα
16.
Η προσθήκη οξέος σε ένα υδατικό διάλυμα μειώνει το pH του, ενώ η προσθήκη
βάσης αυξάνει το pH του διαλύματος.
Το pH του νερού μιας λίμνης,
ενός ποταμού κ.ο.κ. καθορίζεται κυρίως από τη συγκέντρωση του διοξειδίου του
άνθρακα, των όξινων ανθρακικών ιόντων, των ιόντων υδρογόνου και υδροξυλίου (σε
ορισμένες περιπτώσεις υγροτόπων από τις συγκεντρώσεις των θειικών ιόντων, των
μεταλλικών κατιόντων και ανιόντων όπως χλωρίου, θείου κ.ά.), από τη θερμοκρασία,
από τη μεταβολική δραστηριότητα των υδρόβιων οργανισμών και τις διεργασίες αποσύνθεσης
των συστατικών τους. Αυξημένες συγκεντρώσεις διοξειδίου του άνθρακα μειώνουν
το pH του νερού (pH<5), ενώ τιμές pH μεγαλύτερες του 9,5 αντιστοιχούν σε
αυξημένες συγκεντρώσεις δισανθρακικών ιόντων. Σε νερά με ουδέτερο ή σχεδόν ουδέτερο
pH (7-9) η συγκέντρωση των όξινων ανθρακικών ιόντων υπερέχει αυτών του διοξειδίου
του άνθρακα και των δισανθρακικών ιόντων.
Η οξύτητα του νερού καθορίζει τα είδη και την αφθονία των φυτικών και ζωικών
οργανισμών ενός υγρότοπου και επηρεάζει τις οικολογικές διεργασίες που συμβαίνουν
σε αυτόν. Χαμηλές τιμές του pH περιορίζουν τη μακροφυτική βλάστηση και γενικότερα
ακραίες τιμές του pH επιδρούν σημαντικά στην παραγωγικότητα του φυτοπλαγκτού
επηρεάζοντας έμμεσα και τη διαβίωση των ζωικών οργανισμών.
Τα περισσότερα φυσικά νερά παρουσιάζουν σημαντική ρυθμιστική ιδιότητα, αντιστέκονται
δηλαδή, μέσω σειράς χημικών αντιδράσεων, στις απότομες μεταβολές του pH.