|
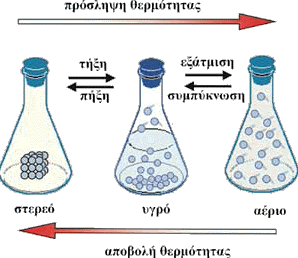
Εικόνα 1.
Στερεή, υγρή και αέρια φάση του νερού Το
νερό είναι ανόργανη χημική ένωση και συναντάται σε όλα τα τμήματα της
βιόσφαιρας (ατμόσφαιρα, υδρόσφαιρα και λιθόσφαιρα) και με τις τρεις
μορφές της ύλης (στερεή, υγρή και αέρια) - (Διαφ.6,
εικ.1) .Το νερό είναι άχρωμο, άοσμο, και άγευστο και σε θερμοκρασία
δωματίου (20ο C) υγρό.
Στην αρχαιότητα το νερό θεωρούνταν στοιχείο. αργότερα ανακαλύφθηκε ότι
είναι η χημική ένωση υδρογόνου και οξυγόνου. Η σύνθεση του προσδιορίστηκε
από τους Λαβουαζιέ, Λαπλάς και Μενιέ, των οποίων οι εργασίες συμπληρώθηκαν
από τους Καρλάϊλ και Νίκολσον (ηλεκτρολυτική ανάλυση του νερού, 1800),
τους Γκάι Λυσάκ και Χούμπολτ (ευδιομετρική σύνθεση, 1805) και τις εργασίες
του Ντυμά (σύνθεση κατά βάρος, 1843).
|
|
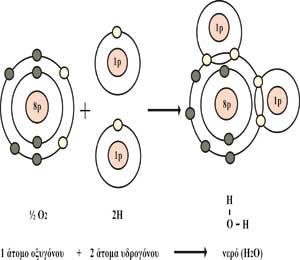
Εικόνα 2. Το μόριο του νερού αποτελείται από δύο άτομα οξυγόνου και ένα
άτομο υδρογόνου.
Ο χημικός
τύπος του νερού είναι Η2Ο. σχηματίζεται δηλαδή από
την ένωση δύο ατόμων υδρογόνου με ένα άτομο οξυγόνου (εικ.2). Το μόριο του
νερού είναι ασύμμετρο και το ηλεκτρικό του φορτίο ασταθές. Ανάμεσα στα άτομα
οξυγόνου και υδρογόνου σχηματίζεται απλός ομοιοπολικός δεσμός (κάθε άτομο
προσφέρει ένα ηλεκτρόνιο, σχηματίζοντας ένα κοινό ζεύγος ηλεκτρονίων). Το
άτομο του οξυγόνου έλκει περισσότερο το ζεύγος ηλεκτρονίων από το άτομο
υδρογόνου και έτσι ο δεσμός
|
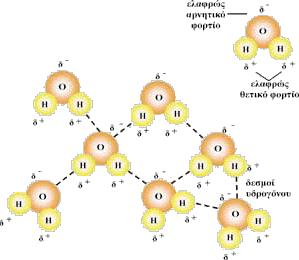 |
Εικόνα 3. Ανάμεσα στα μόρια του νερού σχηματίζονται δεσμοί υδρογόνου. H-O
και κατ' επέκταση τα μόρια του νερού σχηματίζουν ηλεκτρικά δίπολα (εικ.3).
Η έλξη που αναπτύσσεται ανάμεσα στα δίπολα μόρια του νερού (δεσμός υδρογόνου)
είναι η αιτία που το νερό είναι υγρό σε θερμοκρασία δωματίου (20οC) σε
αντίθεση με άλλες χημικές ενώσεις, όπως το υδρόθειο, που στην ίδια θερμοκρασία
είναι αέριες. Αύξηση της θερμοκρασίας προκαλεί εξασθένιση των παραπάνω
δεσμών. Λόγω πολικότητας τα μόρια του νερού μπορούν εύκολα να εισχωρούν
ανάμεσα σε άτομα άλλων μορίων, γεγονός που καθιστά το νερό "παγκόσμιο
διαλύτη". Το νερό διαλύει μικρές τουλάχιστον ποσότητες όλων σχεδόν
των ουσιών. |
Η μεγάλη διαλυτική ικανότητα του νερού συνδέεται με τη διαβρωτική του ιδιότητα
- το νερό διαβρώνει το υπόστρωμα ροής του και εμπλουτίζεται με φερτά υλικά.
Ωστόσο το φαινόμενο της διάβρωσης δεν οφείλεται αποκλειστικά στη διαλυτική ικανότητα
του νερού. Τόσο το νερό της βροχής, όσο και τα επιφανειακά και υπόγεια νερά
δεν είναι ποτέ απόλυτα καθαρά. κατά τη διαδρομή τους στον υδρολογικό κύκλο εμπλουτίζονται
με αέριους βιομηχανικούς και αστικούς ρύπους (διοξείδιο του άνθρακα, οξείδια
του αζώτου κ.ά.), οργανικές ενώσεις από εκτάσεις της ξηράς, ενώσεις αζώτου και
θείου από τις βιομηχανικές δραστηριότητες και τις γεωργικές εφαρμογές, άλατα
όπως το όξινο ανθρακικό ασβέστιο, το χλωριούχο μαγνήσιο, το θειικό ασβέστιο
κ.ά. Οι παραπάνω προσμίξεις εντείνουν τη διαβρωτική ικανότητα του νερού.
|
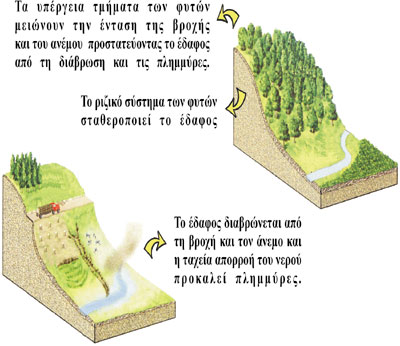
Εικόνα 4. Η αποψίλωση των δασών εντείνει τη διάβρωση του εδάφους και τα
πλημμυρικά φαινόμενα (Miller G. T., 1999: Βιώνοντας στο Περιβάλλον I - Προσαρμογή
από το ΚΠΕ Καστοριάς, 2000)
Στο
σημείο αυτό σκόπιμη είναι η αναφορά στην προστατευτική δράση που ασκεί
η βλάστηση έναντι των κινδύνων διάβρωσης των εδαφών (Διαφ.
8). Τα υπέργεια τμήματα διαφόρων φυτικών οργανισμών και οι νεκροί
φυτικοί ιστοί που καλύπτουν το έδαφος (πεσμένα φύλλα, κλαδιά κ.ά.) μειώνουν
τη μηχανική δύναμη των σταγόνων της βροχής, ενώ το ριζικό τους σύστημα
συγκρατεί το έδαφος και εξασφαλίζει την καλή διαπερατότητά του από το
νερό. Σε περιοχές όπου δεν υπάρχει βλάστηση, ή υπάρχει αλλά είναι λιγοστή,
τα ατμοσφαιρικά κατακρημνίσματα είναι πιθανό να προκαλέσουν πλημμύρες
και διάβρωση του εδάφους (εικ.4). |
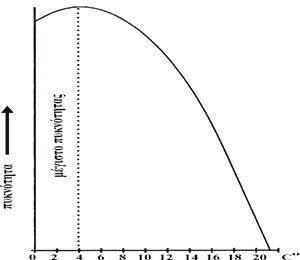 |
Μία ακόμα
ιδιαίτερα σημαντική ιδιότητα του νερού είναι η μεγιστοποίηση της πυκνότητας
του στους 4οC. Μείωση της θερμοκρασίας του νερού μέχρι τους 4οC προκαλεί
αύξηση της πυκνότητας και του βάρους του (εικ.5). Τα βαρύτερα αυτά στρώματα
νερού βυθίζονται, προκαλώντας ανάμιξη των επιφανειακών στρωμάτων με τα βαθύτερα
και εξισώνοντας έτσι τη θερμοκρασία στο σύνολο του όγκου μιας υδάτινης λεκάνης.
Κάτω από τους 4οC η πυκνότητα του νερού μειώνεται (η πυκνότητα του νερού
στην υγρή του μορφή είναι 0,99987g/cm3, ενώ στη στερεή μορφή - πάγος - είναι
0,9164g/cm3) με αποτέλεσμα μεγάλοι όγκοι νερού να μην παγώνουν ολοσχερώς,
όταν η θερμοκρασία είναι ίση με μηδέν ή μικρότερη, αλλά μόνο επιφανειακά.
Το γεγονός αυτό εξασφαλίζει τη ζωή σε λίμνες, θάλασσες και ποτάμια που παγώνουν
κατά τη διάρκεια των ψυχρών εποχών του έτους. Αν το νερό δεν παρουσίαζε
την παραπάνω ιδιαιτερότητα, τα παγωμένα στρώματα της επιφάνειας
θα βυθίζονταν και τα νέα επιφανειακά στρώματα θα πάγωναν και θα βυθίζονταν
επίσης. Σύντομα όλη η υδάτινη έκταση θα αποτελούσε ένα συμπαγές στρώμα πάγου,
όπου καμιά μορφή ζωής δεν θα μπορούσε να επιβιώσει. |
Το νερό χαρακτηρίζεται επίσης
από μεγάλη θερμοχωρητικότητα, οι μεταβολές δηλαδή στη θερμοκρασία του συντελούνται
με σχετικά αργούς ρυθμούς. Η παραπάνω ιδιότητα του νερού οφείλεται στην υψηλή
ειδική του θερμότητα (για να ανέβει η θερμοκρασία 1g νερού κατά 1οC απαιτείται
1cal). Έτσι στο νερό αποθηκεύονται τεράστια ποσά θερμότητας σε σχέση με τα περισσότερα
γνωστά υλικά. Ακριβώς γι' αυτό το λόγο οι θάλασσες, οι ωκεανοί, οι λίμνες και
άλλες υδατοσυλλογές λειτουργούν σαν τεράστιοι θερμοσυσσωρευτές. απορροφούν δηλαδή
θερμότητα, όταν η θερμοκρασία της ατμόσφαιρας είναι υψηλή και αποδίδουν θερμότητα
στην ατμόσφαιρα, όταν ο καιρός είναι ψυχρός. Έτσι οι περιοχές που γειτνιάζουν
με το νερό δεν έχουν απότομες θερμοκρασιακές μεταβολές με αποτέλεσμα το κλίμα
να είναι ηπιότερο και η μετάβαση από εποχή σε εποχή πιο ομαλή.
Τέλος, το νερό έχει μεγάλη θερμότητα εξαέρωσης (540cal/g). για την εξάτμιση
μιας μικρής ποσότητας νερού απαιτείται μεγάλη ποσότητα θερμότητας. Το γεγονός
αυτό έχει μεγάλη σημασία για τους ζωντανούς οργανισμούς αλλά και για τα οικοσυστήματα
γενικότερα.Για παράδειγμα,
οι οργανισμοί μπορούν να αποβάλλουν, μέσω εφίδρωσης, μεγάλες ποσότητες θερμότητας
με περιορισμένες απώλειες νερού.






